Lorsque l’on étudie un gène, on doit en disposer d’une grande quantité (séquençage, mutation, signaux…). Mais on ne peut pas l’isoler directement d’un organisme entier car la quantité extraite sera trop faible. On préfère cribler une banque et trouver à l’intérieur de cette génothèque la bactérie ou le phage contenant notre gène d’intérêt.
Définition : c’est une collection de clones de bactéries ou de phage tous différent les uns des autres car contenant des ADN différents.
Il existe 2 catégories de banques.
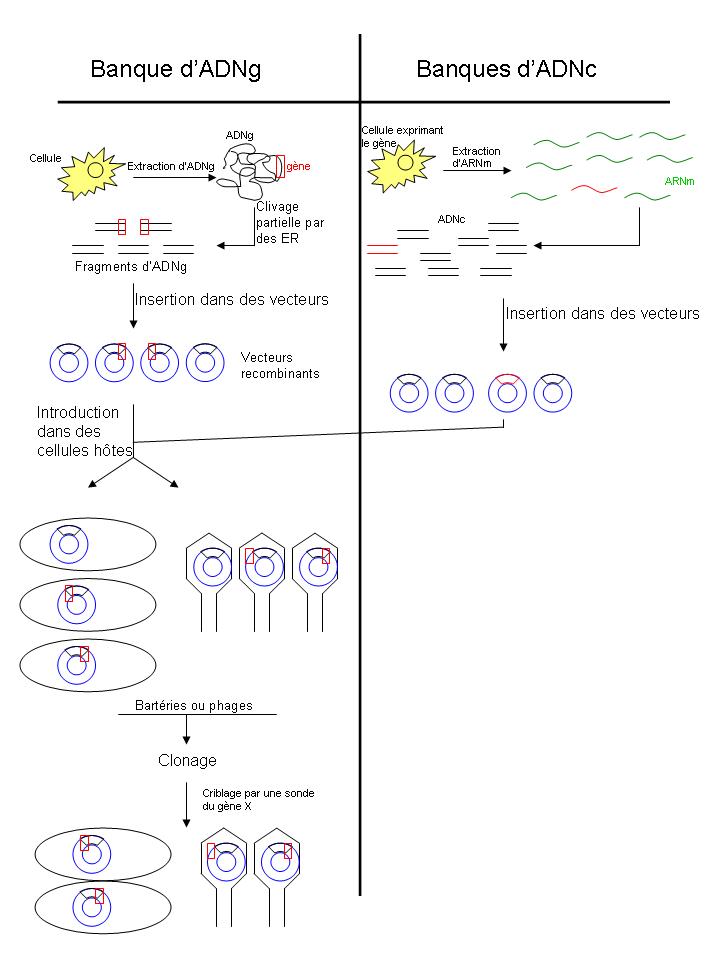
Les banques d’ADNg (ou génothèque) : c’est une collection de bactéries ou de phages contenant chacun un fragment d’ADNg différent. L’ensemble des clones de la banque doit refléter la totalité du génome de départ. Les morceaux d’ADNg contiennent les introns.
Les banques d’ADNc : c’est une collection de bactéries ou de phages contenant chacun un ADNc différent. L’ensemble des clones de la banque doit refléter la totalité des gènes transcrit (=transcriptome) Les inserts ne possèdent pas d’introns.
Attention : les inserts ayant des introns, ceux-ci ne peuvent donc pas être exprimé dans les bactéries ou les phages, car ces derniers sont incapables d’épissage.
Fragmentation de l’ADNg
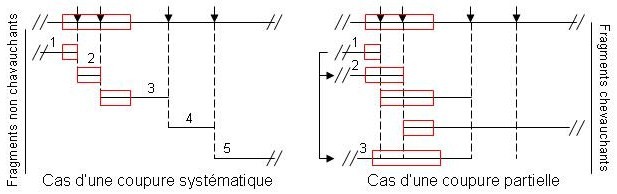
Lorsque l’on fragmente l’ADNg, on choisit une enzyme de restriction à coupure rare, et on la met dans des conditions de digestion partielles. Ainsi, l’enzyme de restriction coupe différemment les différents exemplaires de l’ADNg étudié, ce qui génère des fragments chevauchants. Après un premier criblage, le clone un « péché » permet de récupérer par un deuxième criblage d’autres clones ayant des séquences communes avec lui. Après séquençage de tous ces clones, on peut recoller les morceaux par recouvrement et reconstituer le gène en entier.
Pour les banques d’ADNg, on utilise 3 catégories de vecteurs différent ayant des capacités de sous clonage différent.
- phage λ – permettent d’insérer un fragment d’ADNg de 8 à 22 kb
- cosmide - permettent d’insérer un fragment d’ADNg de 45 kb
- BAC - permettent d’insérer un fragment d’ADNg de 150 à 350 kb (bactérie)
- YAC - permettent d’insérer un fragment d’ADNg de 1000 kb (levure)
Plus le fragment d’ADNg est gros, moins il y a de clones à cribler dans la banque, et il y a plus de chance que le gène soit en un seul morceau.
On utilise chez les phages λ la stratégie de délétion remplacement. C'est-à-dire qu’on délète la partie codant pour la partie lysogénie, et on la remplace par un fragment d’ADNg. Cette stratégie pose 2 problèmes :
- un bras gauche peut se replier sur le bras droit sans inclure d’ADNg
- 2 fragments d’ADNg éloignés dans le génome se récolent dans un même phage
La seconde stratégie est d’utilisé le remplissage de site de restriction par le fragment de Klenow.
Ainsi la seule ligature possible sera : bras gauche – ADNg – bras droit
Les vecteurs sont purement artificiels et regroupent à la fois :
- des propriétés de plasmide (site ori, résistance aux ATB, polylinker ou MCS)
- des propriétés phagique (site cos permettant l’encapsidation)
Inconvénient : manipulation plus délicate que les phages et moins bonne conservation.
Ce sont des chromosomes artificiels bactériens (BAC : plasmide F ; PAC : plasmide P1)
- oriS
- repE ou repF = régulation du nombre de copies
- parA et parB = répartition (ségrégation) des copies du vecteurs dans les cellules filles
- Résistance aux ATB ou lacZ
- Promoteurs PT7 et PSP6
Ces vecteurs sont utilises chez la levure. Les fragments d’ADNg sont de très grande taille. On ne peut pas les séparer par électrophorèse traditionnelle. On utilise l’électrophorèse à champs pulsé. En gros, le champ électrique change de direction de manière alternative. Cette alternation d’orientation du champ électrique force les molécules à se réorienter, or la vitesse et le temps de réorientation de la molécule est proportionnelle à sa taille.
Définition : c’est la copie ADN d’un ARNm sans intron obtenu par transcriptase inverse. Les ADNc ne possèdent pas d’introns et peuvent donc être exprimé par des bactéries. Ces banques sont souvent appelées banque d’expression pour cette raison.
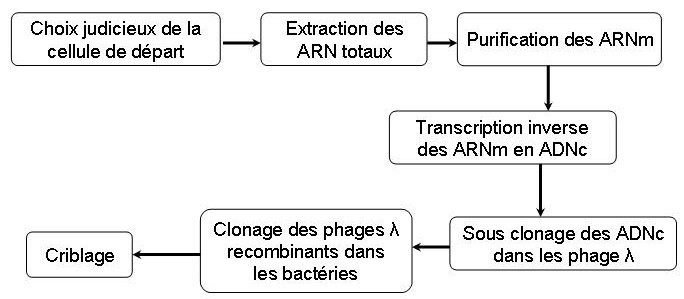
Il faut extraire à partir d’une cellule qui exprime le gène d’intérêt. Sur les 50 000 gènes d’une cellule humaine, seulement 15 000 sont exprimé en moyenne. Le nombre de clone dans une banque d’ADNc et donc compris entre 15 000 et 20 000 clones, contre plusieurs milliers dans une banque d’ADNg. Une banque d’ADNc est donc plus facile à cribler qu’une banque d’ADNg.
Remarque : l’extraction d’ARN est plus délicate que l’extraction d’ADN car les RNAses sont thermorésistantes et non-inhibé par l’EDTA. On doit donc manipuler le plus rapidement possible avec du matériel RNAses free, et on rajoutera au tampon d’extraction un cocktail d’inhibiteur appelé RNAsin.
Il existe 3 techniques d’obtention des ADNc (figure 3, 4 et 5)
La première technique est la synthèse par auto-amorçage (ou self priming). Une amorce d’oligodT permet d’obtenir par RT le 1er brin d’ADNc qui forme une épingle à cheveux en 3’ pour initier la synthèse du second brin. Inconvénient : la nucléase S1 dégrade la partie 5’ de l’ADNc.
La seconde technique est la technique de translation de brèche (Nick translation). Une amorce d’oligodT permet d’initier le premier brin d’ADNc. La RNAseH coupe l’ARN dans l’hétérodioïde ADN-ARN, puis les morceaux d’ARN restant servent d’amorce pour la synthèse du second brin. L’ADN polymérase 1 fait du déplacement de coupures grâce à son activité 5’3’ exonucléases. La T4 ligase bouche ensuite les trous.
La troisième technique est la synthèse par amorcage (priming). Le premier brin d’ADNc est toujours obtenu par une amorce d’oligodT. Le second brin est initié par un oligodG apparié à la queue ployC qu’a ajouté la terminale transférase (seul ADN polymérase capable de fabriquer de l’ADN sans matrice). Avantage : on obtient un ADNc full-lenght sans aucune région d’ARN.
Les vecteurs des banques d’ADNc sont généralement des phages λ car un ADNc dépasse rarement 10 kb (figure 6)
On utilitse généralement la troisième technique des ADNc en accrochant aux amorces des oligodN des liars (linker). Ce sont des sites de restriction simple brin qui sont conservés en bicaténaire. Ils permettent donc de donner à l’ADNc des sites de restriction compatible avec ceux du MCS du phage λ. Cela sous facilite le sous clonage.
Conclusion sur les banques d’ADNc :
|
Techniques
|
Enzymes et réactifs
|
|
Nick translation (déplacement de coupures)
|
DNAse1 (nicks) Pol1 (5’3’ polymérase, 5’3’ exonucléase = déplacement de coupure) |
|
Random priming (amorcage aléatoire)
|
4096 nucléotides + fragment de Klenow (5’3’ polymérase, 3’5’ exonucléase) |
|
Remplissage de sites
|
ER (coupure cohésive 5’ sortante) Klenow (remplissage des sites de restriction) |
|
Marquage en 5’
|
Phosphatase alcaline (enlève le P en 5’) Ploynucléotide kinase (rajoute un P* en 5’) |
|
Marquage en 3’
|
Terminal transférase (pol 5’3’ sans matrice) + dNTP+ ddNTP
|
|
Ribosonde (sonde ARN)
|
Promoteur en amont du gène + ARN pol
|
|
Sonde d’oligonucléotides synthétique
|
Protéine (zone de faible dégénerescence, différentes combinaisons de codons possibles |
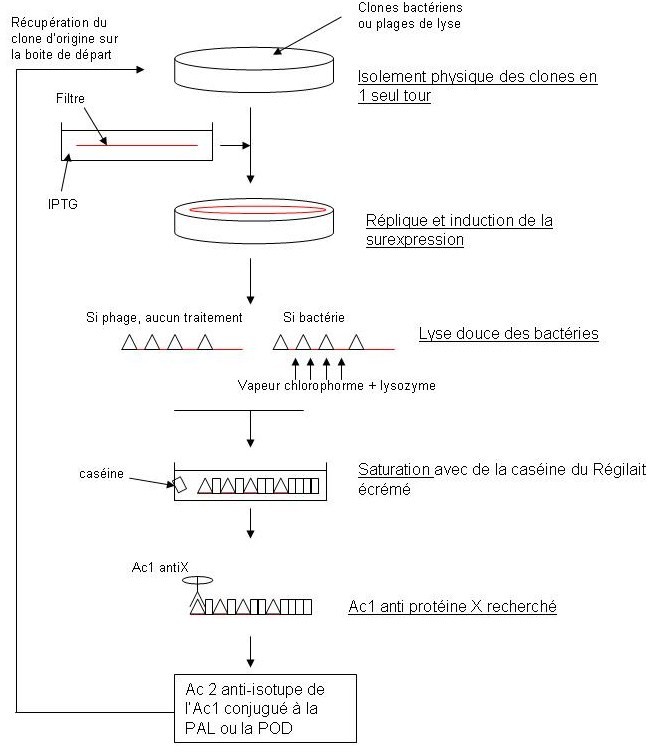
Criblage des banques d’ADNg
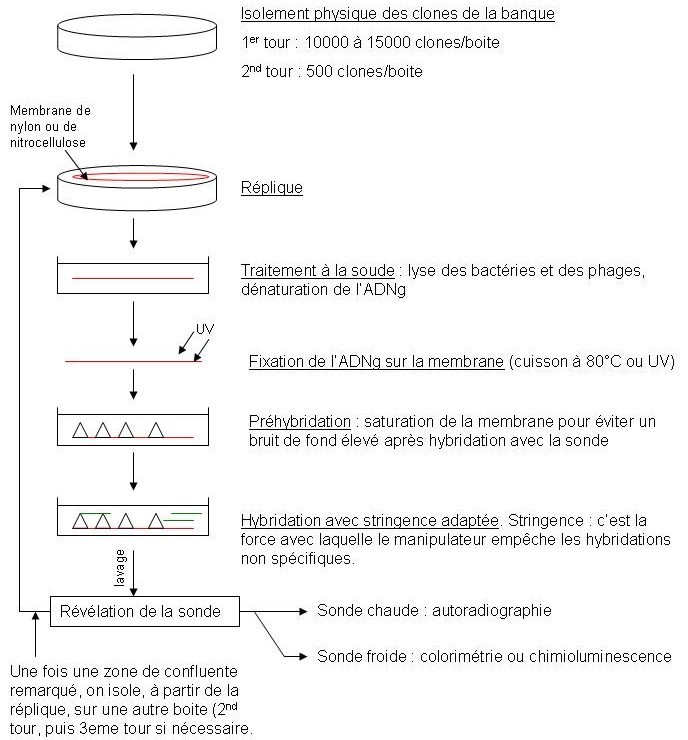
Ces banques sont souvent appelées banques d’expression car les vecteurs utilisés permettent la transcription et la traduction des ADNc. On va donc utilisé pour cribler ces banques des Ac conjugués.