Proto-oncogène, oncogènes, anti-oncogènes
Pour assurer l’homéostasie cellulaire/tissulaire, il faut un parfait équilibre entre la prolifération cellulaire (mitose) et la mort cellulaire (apoptose). Ses deux mécanismes sont étroitement régulés car s’il y a excès de mitose ou s’il y a déficit d’apoptose, il y a alors oncogenèse avec formation d’une tumeur maligne qui peut générer des métastases dans tout l’organisme.
- mitose (cours de première année)
- interphase, comprenant G1 (commence la préparation), S (multiplication de l’ADN), G2 (préparation à la division)
Les phases M, S et G2 ont une durée fixe. Par contre, la durée de G1 est variable, car les cellules peuvent passer en repos G0 (=quiescentes)
Chaque phase du cycle fait intervenir un complexe protéique contenant :
- une cycline exprimée grâce au transactivateur activé par le complexe CDK-cycline précédent.
- Une protéine CDK, c’est une kinase dépendante des cyclines. Ces kinases phosphoryles des S sur sérine et thréonine. (figure 1 et 2)
Chaque complexe CDK-cycline est spécifique d’une étape du cycle. Il phosphoryle plusieurs protéines cibles dont un transactivateur qui passe dans le noyau et qui active la transcription de la cycline suivante et des enzymes nécessaires à l’étape suivante du cycle.
Ex : figure 3 : en fin de G1, le complexe CDK-cycline phosphoryle la protéine Rb qui libère le facteur E2F. E2F est un transactivateur qui passe dans le noyau est permet l’expression des enzymes de duplication de l’ADN.
Ce sont des systèmes de sécurité qui empêche l’avancé vers l’étape suivante tant qui l’étape précédente n’est pas parfaitement achevé.
Ex : figure 4 : lorsque l’ADN subit des mutations en G1, la p53 est activée et inhibe par l’intermédiaire de la p21 le complexe CDK-cycline. Rb n’étant pas phosphorylé, E2F n’est pas libéré et il n’y a donc pas transactivation des gènes pour la phase S. La cellule est donc bloquée en G1 tant que l’ADN ne sera pas réparer (si les réparations sont impossibles, la cellule ne survit pas longtemps dans un état entre 2 phases)
- diminuer la sensibilité à l’apoptose
- perturber les points de contrôle du cycle cellulaire, d’où la division d’une cellule contenant des mutations, et ainsi accumulation de mutation au cours des cycles cellulaire successifs.
Une tumeur est en réalité un clone, c'est-à-dire un ensemble de cellules issues d’une même cellule mère. In vitro, les cellules normales sont généralement adhérentes, donnent une monocouche, et lorsqu’elles arrivent à confluence, il y a inhibition de contact. Les cellules cancéreuses ont une prolifération incontrôlé, elles n’ont pas d’inhibition de contact, et forme des empilements. De plus, elles sont immortelles.
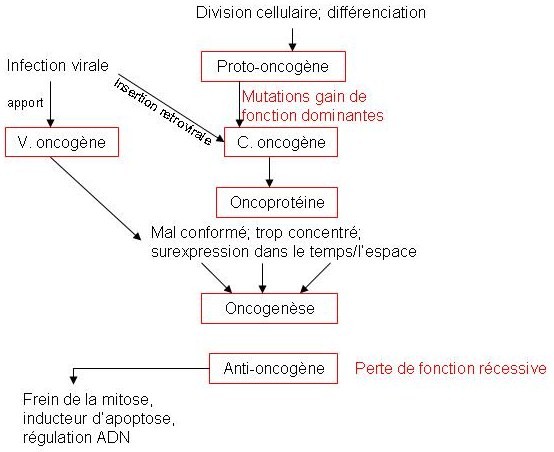
Dans la cellule, nous possédons des gènes très important appelés proto-oncogènes qui régulent le cycle cellulaire, la croissance cellulaire et la prolifération cellulaire. Si des mutations se produisent dans ces proto-oncogènes, elles le dérégulent et les transforment en oncogènes. Ces oncogènes vont échapper à toute régulation, et vont transmettre un signal constitutif d’activation à la cellule (=gain de fonction). Ces mutations sont dominantes, il suffit donc qu’un seul des deux allèles d’un proto-oncogènes soit mutées pour que l’oncogenèse se déclenche.
Pour contrôler la division cellulaire, nous avons besoin de proto-oncogène qui peuvent être :
- facteur de croissance (SIS)
- récepteur de facteur de croissance (EGFR : Epidermal Growth Factor Receptor)
- protéine G (Ras)
- protéine kinase (Raf)
- transrégulateur (Myc)
Les protéines codées par les oncogènes sont appelées oncoprotéines.
- un changement conformationelle de l’oncoprotéine, d’où une augmentation de son activité ou une perte de sa régulation (activité constante)
- l’augmentation de son activité, une augmentation de sa stabilité, une duplication de l’oncogène, une insertion rétrovirale : tout cela aboutit à une augmentation de la concentration de l’oncoprotéine.
- Une translocation chromosomique : expression dans un mauvais type cellulaire, au mauvais moment ou une expression constitutive de l’oncogène
Schéma bilan :
L’oncoprotéine Ras : les mutations ponctuelles du proto-oncogène Ras : le simple changement d’un codon, et donc d’un AA dans l’oncoprotéine transforme Ras en protéine G constitutive, tous le temps activé car incapable d’hydrolyser l’ATP.
Dans la leucémie myéloïde chronique, il y a translocation entre les chromosomes 22 et 9, d’où la fusion entre le gène bcr1 et le proto-oncogène C-abl. On obtient un gène fusion bcr1-abl codant pour une oncoprotéine fusion à activité kinase constitutive. Il y a donc cascade de phosphorylation en continu d’où prolifération cellulaire.
Dans le lymphome folliculaire, il y a translocation chromosomique 14/18, d’où fusion d’un enhancer avec le proto-oncogène bcl-2. Or, bcl-2 est normalement un régulateur négatif de l’apoptose. Sa surexpression bloque totalement l’apoptose dans les lymphocytes B, qui vivent très longtemps, et accumulent du coup de nombreuses mutations.
Le virus de l’érythroblastose apporte dans les cellules infectées l’oncogène viral V-erbB. Ce gène code pour une oncoprotéine correspondant au récepteur de l’EGF raccourcit en NH2 et COOH terminale. Cette oncoprotéine déclenche la prolifération cellulaire en continu même en l’absence d’EGF.
Il s’agit de mutations touchant des gènes suppresseurs de tumeurs et qui induisent l’oncogène seulement qi les deux allèles sont mutées (mutations récessives).
Ces gènes sont appelés anti-oncogène. Ce sont des gènes qui sont impliqués dans l’implication de l’apoptose, dans les points de contrôle de la mitose et dans la réparation des mutations de l’ADN.
La p53 bloque normalement la mitose si l’ADN de la cellule est muté. C’est aussi un inducteur normal de l’apoptose. Dans 50% des tumeurs humaine, les deux allèles codant pour p53 sont mutées, d’où l’absence de blocage de la mitose et pas d’induction d’apoptose, donc la cellule se divise indéfiniment.
