Résume : Speckles
Issu de la review Nuclear speckles : a model for nuclear organelles, Angus I.Lamond and David L. Spector, Nature Reviews/molecular cell biology, V4, August 2003, 605:612
Dans les cellules de mammifère, la machinerie d’épissage des préARNm montre une dynamique, ponctué d’une localisation nucléaire, qui est usuellement appelé « paterne de Speckles », mais qui se réfère au domaine SC35 ou aux compartiments d’épissage. La première connexion entre les speckles et les préARNm a été admise par l’observation de la distribution des snRNPs.
Il est maintenant clair que la localisation ponctuelle des facteurs d’épissage observé par la microscopie à fluorescence correspond à la présence de ces facteurs dans les speckkles nucléaires variables en taille et de forme irrégulière, lesquels ont été observé en microscopie électronique comme « grappe de granule interchromatinien » (interchromatin granule cluster = IGCs). Les chaines d’IGCs ont une taille comprise entre un et plusieurs micromètres de diamètre, et sont composés de granules de 20 à 25 nm qui sont maintenus en place par une fine fibrille, donnant ainsi l’apparence d’une chaine perlée.
Nous appelons ici speckles les composants spécifiques d’IGC en facteurs d’épissage correspondant à un motif, en distinguant les autres structures nucléaires, soit les fibrilles périchromatinienne, les corps de Cajal et les zones d’interchromatine associé aux granules.
Un signal ciblant les speckles a été identifié dans plusieurs composants. Le domaine riche en arginine/serine (domaine SR) de certains facteurs d’épissage des protéines SR ont montrés être nécessaire et suffisant pour le ciblage de ces facteurs vers les speckles nucléaires. Cependant, toutes les protéines visibles dans le modèle des speckles et par IF ne se localisent pas dans les IGCs qui contiennent les facteurs d’épissage. Par exemple, la protéine paraspeckle 1 (PSP1) est localisé dans les paraspeckles, lesquels, bien qu’ayant l’air similaire aux speckles, ont une structure distincte.
Structure et localisation des speckles
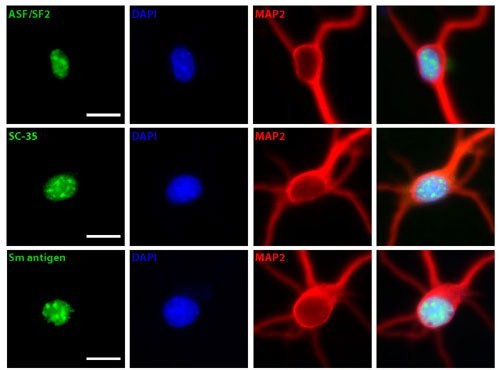 Les IGCs qui constituent les speckles, se situent en une région du nucléoplasme qui ne contient que peu ou pas d’ADN. Cependant, bien qu’ils ne contiennent apparemment que peu, voir pas de gènes, les speckles sont souvent observés près de site de transcription hautement actif. Ceci indique donc qu’ils doivent avoir un rapport fonctionnel avec l’expression de gènes, et quelques gènes ont déjà été reporté avoir été localisé préférentiellement près des speckles, bien qu’il ne semble pas avoir obligatoirement transcription ou épissage des préARNm. Plusieurs points sont à mettre en évidence pour les speckles au niveau du fonctionnement, comme pour le stockage, l’assemblage ou la modification des facteurs d’épissage dans les sites de transcription actif.
Les IGCs qui constituent les speckles, se situent en une région du nucléoplasme qui ne contient que peu ou pas d’ADN. Cependant, bien qu’ils ne contiennent apparemment que peu, voir pas de gènes, les speckles sont souvent observés près de site de transcription hautement actif. Ceci indique donc qu’ils doivent avoir un rapport fonctionnel avec l’expression de gènes, et quelques gènes ont déjà été reporté avoir été localisé préférentiellement près des speckles, bien qu’il ne semble pas avoir obligatoirement transcription ou épissage des préARNm. Plusieurs points sont à mettre en évidence pour les speckles au niveau du fonctionnement, comme pour le stockage, l’assemblage ou la modification des facteurs d’épissage dans les sites de transcription actif.
Il a été montré que les préARNm naissant sont localisé prédominativement à l’exterieur des speckles nucléaires (IGCs) dans des structures fibrinilaires, ayant un diamètre de 3 à 5 nm, et qui sont connu sous le (charmant) nom de fibrilles périchromatine. Il y a beaucoup de facteurs d’épissage co-transcriptionnel qui sont associés à la fibrille périchromatine plutôt qu’aux IGCs.
Il est cependant impossible pour le moment de distinguer les IGCs et la fibrille périchromatine à la microscopie. On peut cependant avancer que les speckles n’interviennent pas dans les centres d’épissage des préARNm, et que les IGCs ne contiennent aucun ARNnaissant en transit vers le cytoplasme.
Composition des speckles
Beaucoup des facteurs d'épissage des préARNm (inclus les snRNPs et les protéines Sr) ont été localisés au niveau des speckles nucléaires par IF, tag de protéine, fluorescence et/ou par microscopie à immuno-électron. En parallèle, plusieurs kinases et phosphatases qui peuvent phospohoryler/dephosphoryler les composants de la machinerie d'épissage ont aussi été localisé au niveau des speckles nucléaires.
Pour le moment, 136 protéines connues ont été identifié d'une fraction purifiée d'IGC (provenant du foie de souris) (donnée non publié). Les informations protéomiques ont révélé que les speckles contiennent des protéines autres que des facteurs d'épissage des préARNm. Les protéines particulièrement intéressantes dans cette localisation sont des facteurs de transcription, des facteurs de maturation de l'extrémité 3' des ARN, eIF4E qui est le facteur eucaryote d'initiation/translation, une protéine impliqué dans l'inhibition de la translation (eIF4Aiii) et des protéines structurales.
De plus, même s'il n'y a pas d'activité de transcription dans la plupart des speckles, et que l'ADN n'est pas localisé dans ces régions nucléaires, une population de la sous unité large 2-serine phosphorylé de l'ARN polymérase II (Pol II), qui est impliqué dans l'élongation, a été localisé dans ces régions par immunofluorescence. Le complexe de division cellulaire kinase 9 (Cdk9)-cycline T1 (aussi connu sous le nom de complexe TAK/P-TEFb) est aussi impliqué dans l'élongation transcriptionnel à travers la phosphorylation de la large unité de Pol II. Ce complexe a été trouvé diffusé dans le nucléoplasme, mais pas dans le nucléole.
En plus des facteurs de transcription, une population d'ARN poly(A)+ a été localisé dans les speckles nucléaire. On ne sait toujours pas si ces ARN codent pour des protéines ou si se sont des ARNs non codant. Intéressement, cette population d’ARN poly(A)+ n’est pas transporté vers le cytoplasme quand la transcription est bloquée, ce qui pourrait ainsi signifier que ce type de ARN sont des ARNm naissant. Il a été récemment proposé que les ARNs associés au speckles doivent être défectueux en transcription à ne jamais quitter le noyau, ou, plus surement, qu’ils représentent un type d’ARN avec une fonction nucléaire précise.
Plusieurs protéines avec un rôle structural (comme les lamines A et les snRNP associé à l’actine) ont été identifiées dans les speckles nucléaires. De plus, un lipide régulant les protéines liant l’actine, la phosphatidylinositol 4,5-biphosphatase, et plusieurs phosphates phosphatidylinositols kinases ont été localisés dans les speckles nucléaires.
Comportement dynamique des speckles
Les speckles sont des structures dynamiques et leur taille, forme et nombre peut varier, s’accordant au niveau de l’expression des gènes et à la réponse du métabolisme ainsi qu’à l’environnement du signal, qui va influencer les voies disponibles pour les facteurs d’épissage et de transcription. Quand la transcription est arrêtée, en utilisant des inhibiteurs ou un choc thermique, les facteurs d’épissage s’accumulent prédominativement dans des speckles élargis et arrondis. Ces speckles nucléaires deviennent arrondis et leur taille augmente, montrant ainsi que les speckles ont une fonction de stockage, d’assemblage et de modification des facteurs d’épissage, et qu’ils ne sont pas des sites directs d’épissage. Plus loin, quand l’expression de gènes contenant des introns augmentent, ou quand le niveau de transcription est augmenté lors d’une infection virale, l’accumulation des facteurs d’épissage dans les speckles est réduite et sont redistribué dans les sites de transcription nucléoplasmique. Les composants individuels des speckles peuvent faire la navette entre les speckles et le loci actif de gènes.
Le mouvement des facteurs à l’intérieur et à l’extérieur des speckles peuvent être directement observé pas microscopie à fluorescence comme des fluctuations dans la forme et l’intensité des speckles dans les cellules vivantes qui expriment les facteurs d’épissage couplé à
Les speckles et le cycle cellulaire
A l’entré de la mitose, et après le déchirement de l’enveloppe et des lamines nucléaire, les protéines qui sont associées avec les speckles nucléaires diffusent et sont distribuées dans tout le cytoplasme. Durant la métaphase, ces protéines continuent à se localiser dans le cytoplasme avec une des trois structures connu comme étant les granules interchromatinien mitotique (mitotic interchromatine granules – MIGs-). Les MIGs ont une structure analogue à celle des IGCs. Lors de la progression de la mitose de l’anaphase à la télophase tardive, les MIGs augmentent en taille et en nombre. Lors de la seconde partie de la télophase tardive, et après la destitution de l’enveloppe nucléaire, les facteurs d’épissage des pré-ARNm entrent dans la cellule fille, et leur localisation avec les MIGs diminue, montrant que ces facteurs sont recyclés du cytoplasme vers le noyau des cellules filles. Les études sur les cellules vivantes ont montré que la plupart de ces facteurs entre dans le noyau de la cellule fille en 10 minutes.
Alors que les MIGs sont proposés être l’équivalent mitotique des speckles nucléaires, leur fonction dans les cellules mitotiques n’est pas claire. La proximité des MIGs de la périphérie nucléaire, et leur disparition lors de la télophase tardive et leur ressemblance troublante avec les IGCs dans les cellules filles indiquerai que les MIGs serai directement transporté vers le noyau. Cependant, la co-localisation des SF2/ASF et d’une forme hyper phosphorylé de l’ARN Pol II (H5) dans les MIGs lors de la télophase tardive indique que ce ne devrait pas être le cas. Par exemple, SF2/ASF et d’autres facteurs d’épissage des pré-ARNm ont montré entrer dans le noyau fille, alors qu’une sous population de SC35 et Pol II (H5) reste dans les MIGs jusqu’à la phase G1, montrant que les différents composants des MIGs rentrent dans le noyau fille différemment.
Intéressement, les facteurs d’épissage sont compétant pour l’épissage des pré-ARNm immédiatement après leur entré dans le noyau fille, supportant la possibilité que MIGs pourrait être responsable de la modification des facteurs d’épissage, permettant le ciblage immédiat des pré-ARNm au site de transcription dans le noyau télophasique.
Perspectives/Discussion
Un modèle a été proposé, appelé modèle échange-régulé (regulated-exchange model), basé sur les propriétés connues de la dynamique des speckles ainsi que sur leur formation et leur organisation. Les principaux points du modèle sont résumés en plusieurs points :
- La plupart des expériences permettent de conclure que les speckles ont un mode d’assemblage indépendant, et ne dépendent donc pas de structures sous jacentes. Par conséquent, les interactions transitoires macromoléculaires sont probablement formées par la morphologie de base des speckles.
- En état d’équilibre, les rythmes respectifs d’association et de différenciation des composants des speckles définissent leur niveau d’échange, la taille de leurs limites ainsi que leur solubilité dans le noyau.
- Les mécanismes régulatoires peuvent influencer leurs rythmes d’association et/ou de dissociation, et changer ainsi leurs limites et les composants solubles des speckles en réponse à des signaux cellulaires spécifiques.
Les mécanismes pouvant réguler l’activité des speckles serai les cycles de phosphorylation/déphosphorylation au niveau des domaines SR des facteurs d’épissage SR.
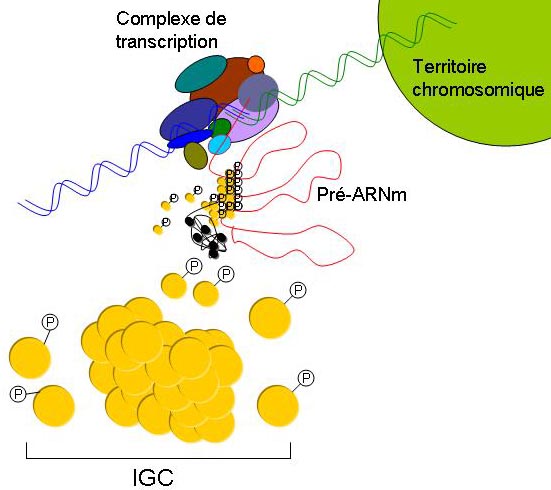
Schéma : Les speckles nucléaires sont le résultat d’interaction protéine-protéine parmi les acteurs d’épissage des pré-ARNm et d’autres constituants. Les échanges entre les speckles et le pool nucléaire est régulé par les cycles de phosphorylation/déphosphorylation. Les modulations du niveau de phosphorylation des protéines du speckles sont augmentées au niveau des sites de transcription.
Le schéma n’est pas à l’échelle.
Il reste cependant comme même beaucoup de points à éclaircir :
Quel est le mécanisme précis de formation des speckles ?
Les speckles vont aléatoirement dans le noyau de la cellule fille, ou on-t-il une position établit au niveau d’un domaine chromosomique, du loci d’un gène ou d’une autre structure ?
La taille et le nombre des speckles est-elle prédéterminée ?
Quelle est le rôle des ARN polyA+ dans les speckles ?
