Mise en évidence de la lysogénie
Le phage utilisé est le phage P1, qui est un phage présentant la particularité de posséder un répresseur thermolabile, induisant la lyse cellulaire si la température est supérieure à 42°C, et induisant la lysogénie si la température est d’environ 28°C. La souche sensible de ce phage est Escherichia coli K12
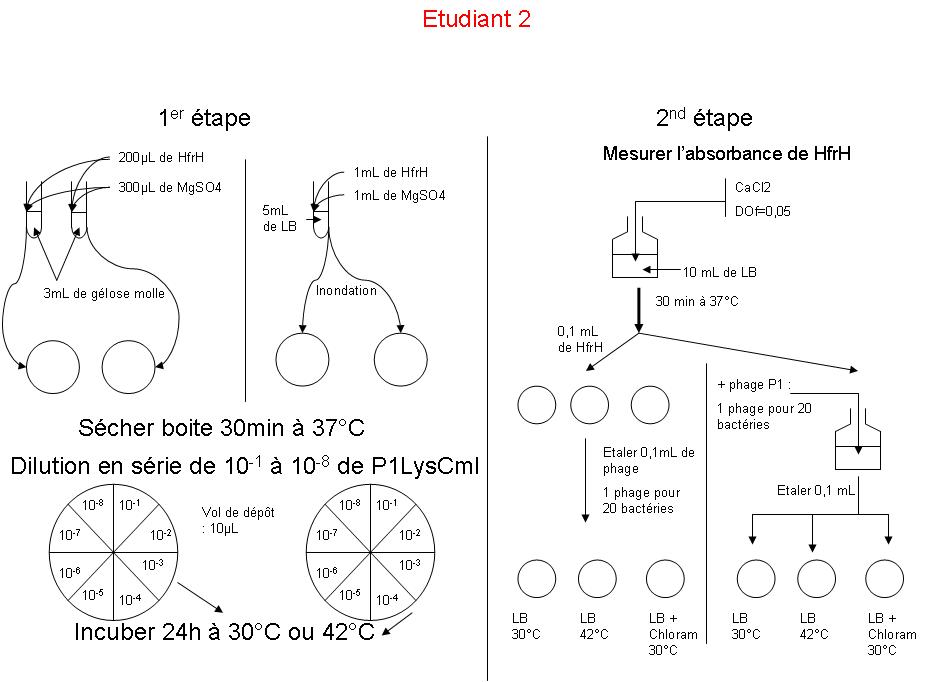
Etant l’étudiant 2, j’ai réalisé les manipulations suivantes :
Abs HfrH : 0.441, dilué au dixième
Calcul du volume de culture à insérer
Ainsi, pour avoir une DOf de 0.05, avec une DOi de 4.41, il faut insérer 115µL de culture dans 50mL de LB. Pour avoir une concentration finale de 0.005mM de CaCl2, il faut mettre 50µL dans les 50 mL de LB. J’ai admis que la variation de volume n’est pas suffisamment importante pour modifier la concentration ou la DO finale.
Absorbance après une heure d’incubation pour HfrH : 0.096 UA
Sachant que 1UA est environ égale à 1.108 bactéries/mL
On a ainsi 0.096=9.6.106 bactéries/mL, que l’on peut arrondir à 107 bactéries/mL
On va déposer un volume de 100µL de HfrH, soit une quantité de 106 bactéries.
On souhaite avoir un phage pour 20 bactéries, sachant que la solution de phage est titrée à 5.109 UFP/mL
106/20 = 5.104 phages/0.1mL, soit 5.105 phages/mL
|
Dilution
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
10-7
|
10-8
|
|
UFP/mL
|
5.108
|
5.107
|
5.106
|
5.105
|
5.104
|
5.103
|
5.102
|
5.101
|
Je choisis donc la dilution 10-4 du phage pour réaliser l’étalement.
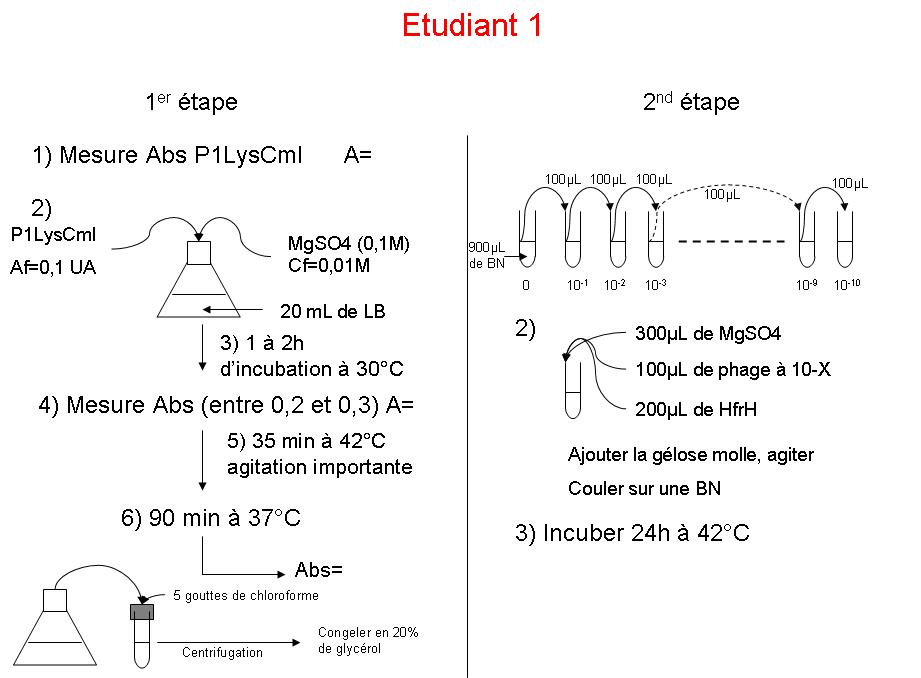
Etudiant 1 :
Titrage du phage
|
Dilution
|
10-4
|
10-5
|
10-6
|
10-7
|
10-8
|
|
Nathalie
|
NC
|
2370
|
304
|
23
|
0
|
|
Christopher
|
NC
|
2510
|
306
|
30
|
0
|
Ces valeurs sont pour 100µL de la dilution de phage.
Où N correspond au nombre de plage de lyse comptée
d correspond à la plus grande dilution pris en compte
n1 et n2 correspondent au nombre de boites où sont comptées les plage de lyse
Ainsi, je trouve un titre de phage de 3,01.109 plages de lyse/mL
Valeur d’absorbance
Intermédiaire (compris entre 0.2 et 0.3) : 0.219
Absorbance finale (après action des phages) : 0.071
La suspension de départ, qui est la préculture, est relancé, de sorte pour que la DO soit au final de 0.1, soit :
Le volume de MgSO4 nécessaire est de 2mL pour donner une concentration finale de 0.01M.
L’absorbance intermédiaire est nécessaire pour vérifier que la bactérie atteigne la phase exponentielle de croissance.
On passe ensuite à la phase de lysogénie. L’augmentation de température (à 42°C) a pour effet de réveiller le phage, qui rentre ainsi dans un cycle infectieux.
On repasse à 37°C, mais le phage est tout de même en lysogénie, et va donc lyser ses cellules hôtes, et par la même occasion, diminuer l’absorbance, qui est mesuré pour confirmer cette tendance.
Etudiant 2
Titrage du phage en milieu solide
A 30°C : Aucune plage de lyse pour les 2 préparations
|
Dilution
|
10-4
|
10-5
|
10-6
|
|
Nbre de plages de lyse |
NC
|
110
|
9
|
Interprétation : Il est normal qu’à 30°C, qu’aucunes plages de lyse n’apparaissent sur le milieu, car celui-ci n’est pas à la température de lysogénie, mais à une température inférieure. Le phage n’est donc pas entrer en phase lytique, et la bactérie a pu pousser normalement sur le milieu.
Il est curieux que la première préparation n’est pas du tout fonctionné. Peut être du fait que ce soit dut à l’étalement successif de la bactérie et du phage, et où la bactérie a été complètement « mangé » par le phage avant qu’elle n’est eu le temps de pousser.
Pour la température de 42°C, la température de lysogénie est atteinte, et le phage est ainsi rentrer en phase lytique, provoquant alors des plages de lyse lorsque sa dilution n’était pas trop faible ou trop importante.
Je peux cependant déterminer le titre du phage sur cette préparation, toujours par la norme AFNOR.
Par cette méthode, je trouve un titre de 1,08.1010 phage/mL
Caractère de résistance :
A 30°C : LB: pousse ++ LB+chloramphénicol : pousse ++
A 30°C : LB : pousse +++ LB+chloramphénicol : pousse ++
Globalement, je peux dire que la pousse à 42°C est légèrement plus faible que celle à 30°C. Cependant, le tapis bactérien est tellement dense que je n’arrive pas à distinguer de plage de lyse, qui devrait être pourtant présente, vu que la température de lysogénie est atteinte.
Je peux dire la même chose pour la pousse en présence de chloramphénicol, elle est légèrement plus faible que la pousse sur le même milieu, à 30°C, et sans chloramphénicol.
Dans l’ensemble, la préparation 2 légèrement mieux fonctionné que la préparation 1, du fait qu’il y a eu une meilleur croissance de la bactérie sur milieu LB à 30°C.
Le chloramphénicol est un bactériostatique très puissant, donc utilisé pour arrêter la croissance bactérienne. HfrH est normalement sensible au chloramphénicol, cependant, l’insertion du phage dans son ADN lui permet d’exprimer ces gènes, dont le gène de résistance au chloramphénicol. Je peux donc ainsi avancer que les bactéries poussant sont chloramphénicol possèdent dans leur ADN le phage, et sont donc lysogènes. Le fait que la bactérie pousse moins rapidement est probablement du au fait que le chloramphénicol exerce une pression, inhibant ou ralentissant certaines voies cellulaires.
Ainsi, je peux déjà annoncer que le caractère de lysogénie des bactéries a été mis en évidence avec succès lors de la première étape de l’étudiant 1. En effet, on observe une très nette diminution de l’absorbance une fois que la culture a été passée à une température de 42°C. Je peux également dire que le caractère de résistance au chloramphénicol ne peut apparaitre que si le phage c’est insérer dans le génome de son hôte. Je peux donc avancer que la bactérie est lysogène de part l’apparition de la résistance au chloramphénicol.
Les deux méthodes de titrage des phages, un en gélose molle, l’autre en étalement, a montré que seule la méthode de la gélose molle est fonctionnelle, et qui donne un titrage de phage de 1,08.1010 plage de lyse/mL. En comparaison avec le titrage de phage de l’étudiant 1, qui donne un titre de 3,01.109 plages de lyse/mL, les résultats sont relativement proches, malgré une méthode différente. Dans le cas de l’étudiant 1, le phage et HfrH sont mis en contact avant le coulage de la gélose molle, alors que l’étudiant 2 coule la gélose molle avec HfrH, fait sécher, puis dépose les dilutions de phage. Cependant, l’étalement de HfrH, puis les dépôts des dilutions de phages ne semblent pas fonctionner, probablement du fait que les phages lysent toutes les bactéries dans leur rayon d’action.
