Le choix : - des caractéristiques de l’analyte
· Pure ?
· A séparer des autres composés ?
· En concentration suffisante ?
· A récupérer après dosage ?
· Quel volume disponible ?
- des caractéristiques de la méthode :
Précision, sensibilité, coût, rapidité…
1. La pH metrie
1.1.Définition
Le pH est la mesure de l’acidité ou la basicité d’une solution.
pH : potentiel hydrogène = -log [H3O+]
En réalité, seul les ions participent à la réaction :
pH = -log aH3O+
a : activité = γ [H30+]
γ : coefficient d’activité (compris entre 0 et 1)
Produit ionique de l’eau [H3O+]*[OH-] = 1,008.10-4 à 25°C.
è la concentration de H3O+ varie de 1 à 10-14 mol/L
è échelle de pH, de 0 à 14
Influence de la température : déplace l’équilibre ionique
Ex. : à 60°C, le pH de l’eau est de 6,51.
1.2.Les différentes méthodes de mesure du pH
· Les indicateurs colorés : ce sont des substances organiques qui présentent une couleur différentes sous forme basique ou acide. Utilisés en solution ou en mélange sur des bandelettes.
· Les méthodes potentiometrique : c’est une mesure de différence de potentiel entre 2 électrodes plongées dans la solution.
· Electrode à hydrogène : c’est la méthode absolue. Son potentiel vaut 0.
· Electrode de verre.
1.3.La chaîne de mesure en pH metrie
Elle est composée de :
· Un millivoltmètre
· Une électrode de verre
· Une électrode de référence
· Une sonde de température
· Solutions étalons de pH connus
- Electrode de verre : une membrane de verre mise au contact de 2 solutions de valeurs de pH différents, développant entre ses parois une différence de potentiel électrique proportionnel à la différence de la valeur du pH.
- Electrode de référence : son potentiel reste constant à une température donné quel que soit le milieu dans lequel elle est plongée
- Electrode combinée : elle combine en une seul entité une électrode de verre et une électrode de référence (2 fils dans un câble).
1.4.Etalonnage de la chaîne de mesure
Il doit être réaliser avec des solutions étalons à pH connu et dans les mêmes conditions que les mesures sur les solutions inconnus : même température, agitation, même critère de stabilité (durée au bout de laquelle l’appareil donne une valeur stable).
Résultat : droite d’étalonnage (réponse linéaire en fonction du pH) voir doc 2
è Pente : sensibilité de la membrane de verre
è pH0 : pH pour lequel le pH-mètre mesure 0 mV.
Ses deux paramètres d’étalonnage sont calculés et mémorisés par le pH-mètre. Les tensions mesurées par le pH-mètre sont définit par la loi de Nernst (voir cour de chimie).
1.5.Exemple d’application (doc 3)
· Mesure pH d’une solution
· Titrage acide/base
· Détermination pHi et pKA
2. Conductimètre
C’est la mesure de la capacité, pour une solution, à conduire l’électricité.
2.1.Principe et définition
· Electrolyte : c’est une solution dans l’eau. Un sel est un composé ionique composés de cations et d’anions, formant un produit neutre sans charge net. C’est un milieu conducteur dans lequel les ions se déplacent sous l’effet d’un champ électrique (Fig. 1).
· Conductance : inverse de R
Loi d’Ohm : U = R*I
R = (1/G)*I
è Mesure : cellule conductimètrique (fig. 1 et T.D.).
è Facteur d’influence :
- caractéristique de la cellule
- la nature et la concentration des ions
G = σ*(S/l)
σ : conductivité S : surface des électrode l : largeur entre les électrodes
G : conductance S/m
G : σ*constante de la cellule
- conductivité : σ= Σ (zi*Ci*λi)
zi : charge de l’ion Ci : concentration ion λi : conductivité molaire ionique
La conductivité molaire ionique dépend de la nature de l’ion, du solvant, de la température et de la concentration. La valeur est donnée dans les tables à dilutions infinies.
2.2.Utilisation du conductimètre (voir T.P.)
L’étalonnage se fait à une température donnée et à une concentration de KCl connu.
2.3.Exemple d’application
· dosage par détermination d’un volume équivalent
· dosage par mesure de la conductivité d’une solution étalon, puis tracer la droite
· constante de solubilité
· conductimètre en sortie de colonne HPLC comme détecteur
3. La spectroscopie d’absorption moléculaire dans l’UV et le visible
3.1.Définition
Méthode couramment employée pour déterminer la concentration en substance en solution dans un mélange complexe. Cette méthode utilise la propriété de certains composés d’absorbés d’avantage la lumière à certaines longueurs d’onde.
Chromophores : groupement d’atomes au sein d’une molécule présentant une absorption dans l’UV ou le visible. (doc 2)
3.2.Spectres d’absorption
Les molécules incolores peuvent être colorés par des réactifs => dosage colorimétrique
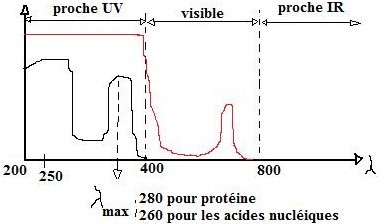
Choix de la cuve :
Il y a les cuves plastiques visibles mesure λ≥340nm
cuves plastique UV mesure λ≥280nm
cuves en quartz mesure λ<280nm
3.3.Loi de Beer-Lambert
Enoncé : quand un faisceau de lumière monochromatique d’intensité I0 traverse une solution contenant des molécules absorbantes, une partie de la lumière est absorbée. L’absorbance est proportionnel à la concentration de la molécule qui absorbe dans le milieu de culture.
A=ε*l*C
ε varie en fonction de la longueur d’onde.
Condition de validité :
· Lumière monochromatique
· Solution diluée
· Milieu homogène non fluorescent
Loi d’additivité des absorbance dans un mélange
AMélange = A1+A2…= ε1lC1+ ε2lC2
Conséquence : il faut tenir compte de l’absorbance du réactif, de la cuve, donc, soit on les mesure séparément, et on les soustrait, soit on lit directement un blanc réactif (spectro. bi faisceau, soit on fait un zéro sur le blanc réactif si spectro. mono faisceau).
Limite de linéarité, limite de détection, sensibilité (voir cour et T.P.)
3.4.Schéma de principe d’un spectro.
è Spectro. mono faisceau
Choix de la longueur d’onde, sélection grâce à un filtre ou à un monochromateur.
Réglage du zéro, sur un blanc réactif, puis lecture de l’échantillon
è Spectro. bi faisceau
Sélection de la longueur d’onde par un monochromateur. 2 emplacements, un pour le blanc réactif, l’autre pour l’échantillon.
L’affichage se fait directement, Aech. - Ablanc
Vérifier le zéro électrique lorsque le spectro est vide, positionner les cuves, et lire directement.
L’avantage de ce système est que lorsque l’on a une référence qui évolue dans le temps ou avec la longueur d’onde.
Contrôle de l’appareil : la longueur d’onde affichée est elle exact? Contrôle avec une solution d’holmium.
A affiché est elle exact ? (Bichromate de potassium)
3.5.Exemple d’application et méthode de dosage
· Dosage des protéines :
- Biuret
- Bradford
- Folin-Lowry
- Absorbance à 280 nm : spectrophotométrie UV
Dosage des acides nucléiques : Absorbance à 260 nm, spectroscopie UV.
· Différentes méthodes de concentration d’échantillon :
Premier cas : on connaît ε.
Problème : ε varie selon les conditions opératoires (pH, solvant…) C’est cependant très utilisé en enzymologie.
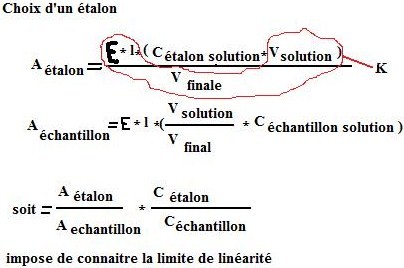
Deuxième cas : ε inconnu è 1 ou plusieurs étalons de concentration connues
Impose de connaître la limite de linéarité.
è plusieurs étalons : gamme d’étalonnage A=f(C)
Avantage :
On vérifie le domaine de linéarité
On minimise les erreurs en traçant une droite moyenne
