Chapitre 1 : organisation générale d’un laboratoire et mise en œuvre des réactifs
1. Organisation d’un laboratoire
1.1.Généralités
Locaux généraux ou spécifiques (culture cellulaire) matériel avec ses problèmes de maintenance, réactifs achetés ou préparés, méthode utilisé (protocole) et financement.
1.2.Les principaux laboratoires de recherche
-organisme de recherche publique :
CNRS (centre national de recherche scientifique)
INSERM (institut national de la santé et de la recherche médicale)
INRA (institut national de la recherche agronomique)
-organisme de recherche privé :
Sanofi-aventis
Institut Pasteur
Institut Mérieux
2. Les exigences au laboratoire
Normes, assurance qualité et traçabilité
2.1.Les normes ISO
2.1.1. Définitions
ISO : organisation internationale de normalisation
Il s’agit d’un organisme non gouvernemental, international, qui produit des normes dans les domaines industrielles et commerciaux.
2.1.2. Exemples
ISO 9000 : management de la qualité
Recouvre tout ce qu’un organisme réalise pour répondre :
-aux exigences qualités du client
-aux exigences réglementaires tout en visant à améliorer la satisfaction du client et les performances dans la recherche de ces objectifs.
ISO 14000 : management environnemental
Recouvre tout ce qu’un organisme réalise pour :
-réduire les effets dommageables de ses activités sur l’environnement
-réaliser une amélioration continue de ses performances environnementales
2.2.L’assurance qualité
Elle prend comme référence les normes ISO 9000 « fait le bien dès la première fois » et «va droit au but »
Mise en place par l’entreprise, elle est le contraire de l’improvisation
Il faut :
-préétablir ce que l’on doit faire
-le faire
-apporter la preuve que cela a été fait.
La trace écrite constitue la traçabilité
2.3.Les BLP(Bonnes Pratiques au Laboratoire)
Elles consistent à renforcer la sécurité au laboratoire, la traçabilité des manipulations, assurer la reproductibilité des résultats.
Voir fascicule p14
2.4.Tenue du cahier de laboratoire
Il permet l’enregistrement des données techniques et assure la traçabilité. Il s’inscrit dans l’assurance qualité (voir TP)
3. Hygiène et sécurité au laboratoire
Voir fascicule
¤Les risques, catégorie de danger :
- phrase R : phrase type indiquant les risques particuliers du produits
- phrase S : phrase type indiquant les précautions à prendre pour manipuler et se protéger du produit.
¤La prévention, l’élimination des déchets
¤les FDS : Fiches de Données de Sécurité
¤A chaque catégorie de danger sont associé des symboles de danger, des phrases de types R et S. Il doit figurer sur l’étiquette du produit et ses dilutions.
¤INRS : Institut National de Recherche et de Sécurité. C’est un organisme qui s’occupe de la prévention des accidents du travail et des maladies professionnelles.
4. Préparation des réactifs et des échantillons
4.1.Définitions
Echantillon : une solution qui contient l’espèce recherché (analyte), plus le reste des composés en nombre variable (=la matrice)
Analyte : c’est l’espèce à doser qui doit être en quantité suffisante
Réactif : composé qui réagit de façon caractéristique en présence d’une autre espèce et qui permet d’en attester la présence ou d’en mesurer la quantité.
4.2. Méthode de préparation des réactifs
- Par pesée à partir d’un solide chimiquement pure (lire les étiquettes) (attention à la présence d’eau cristallisé), tenir compte de l’eau cristallisé dans les calculs, peser avec l’aide d’une balance analytique.
- Par dilution d’une solution déjà préparé
4.3.Etiquetage (voire doc 2)
Mettre : nom, concentration, date et les pictogrammes de sécurité
4.4.La conservation
Le but est de conserver l’intégrité du produit.
¤ La lyophilisation : c’est une technique de déshydratation par le froid et le vide.
Première étape : congélation (T inférieur à -20°C)
Deuxième étape : mise sous vide : sublimation, l’eau se transforme en gaz
Troisième étape : séchage final
On obtient donc un extrait sec qui se réhydrate en quelques minutes. Ce processus respect l’intégrité des cellules mais est très onéreux.
On est donc capable de conserver les vaccins, les hormones, les enzymes, le lait maternel.
Il est aussi possible d’utiliser un agent protecteur (SAB : sérum albumine bovine, ou le lait écrémé, qui contient de la caséine).
¤congélation : passage rapide à une température comprise entre -40°C et -80°C. L’objectif est de bloquer l’eau sous forme de glace dans la situation où elle se trouvait (état liquide).
Agent protecteur : -DMSO (dimethylsulfoxyde)
-glycérol (pénètre dans la cellule)
-PEG (polyéthylène glycol)
¤sous atmosphère inerte : air chassé et remplacé par un gaz neutre (hélium, azote)
¤sous vide d’air : air chassé
4.5.Préparation des solutions tampons
4.5.1. Définition
C’est une solution qui stabilise le pH malgré :
-l’addition de petite quantité de base ou d’acide
-dilution
C’est un mélange d’un acide faible et de sa base conjuguée
Ex : CH3COOH/CH3COO-
H3PO4/H2PO4-
H2PO4-/HPO42-
H2CO3/HCO3-
L’ion hydrogénocarbonate maintien le pH dans le sang entre 7,35 et 7,45.
4.5.2. Relation d’Handerson-Hasselbach
AH+H2O === A-+H3O+
[H3O+].[H-]
Kdissociation === ------------------
[AH].[H2O]
[H3O+].[A-]
Ka==-----------------
[AH]
Ka= la constante d’acidité, selon les acides, entre 10-3 et 10-13
[H3O+].[A-]
Log Ka== log -----------------
[AH]
Log Ka== log[H3O+] + log [A-]/[AH]
- log[H3O+] = -log Ka + log [A-]/[AH]
pH = pKa + log [A-]/[AH]
C’est l’expression du pH d’une solution d’un acide faible en fonction du pKa et des rapports des concentrations de l’acide et de sa base conjuguée.
Courbe de titration d’un acide faible par une base forte (doc 5)
Au point de la demi équivalence, pH=pKa
Le pouvoir tampon maximal d’une solution est obtenu par mélange équimolaire
Mécanisme de maintien du pH
- ajout d’une base forte à la solution tampon
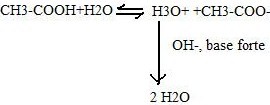
L’équilibre se déplace à droite, tout les OH- sont captés par l’acide pour former la base conjuguée. Le pH n’augmente que légèrement.
- ajout d’un acide fort à la solution tampon
L'équilibre va dans le sens inverse lorsque l'on introduit une base forte.
Les ions H3O+ sont captés par la base de la solution tampon pour former l’acide conjugué.
C’est la proportion des molécules acides et bases qui va être modifiés, mais le pH variera beaucoup moins si ces molécules n’était pas présentes dans l’eau.
4.5.3. Calculs des solutions tampon
¤ Efficacité : on peut le mesurer au cour de l’ajout d’acide ou de base. Plus le pouvoir tampon d’une solution est élevé, plus elle peut absorber une grande quantité de base ou d’acide.
Exercice : voir feuille
¤Pour la préparation d’une solution à pH donné, il faut choisir un acide dont le pKa ne diffère pas de plus d’une unité de pH par apport à la valeur du pH désiré.
Ex: CH3-COOH/CH3-COO-
pKa =4,76 => tampon compris entre 3,76 et 5,76
4.5.4. Conservation et influence de la température
Conservation : on prépare et on conserve des solutions d’acide et de base conjugué concentrée
Influence de la température : le produit ionique de l’eau varie avec la température, donc le pH varie.
Chapitre 2 : Metrologie
1. Généralité, définitions
C’est la science de la mesure au sens large.
La mesure est l’opération qui consiste à donner une valeur à une observation
1.1.Historique
- avant la révolution française : pouce, pied, lieu, toise…
-révolution française : introduction française : système de référence basé sur des objets ayant la même valeur pour tous.
-1875 : début de la metrologie =>création du bureau international des poids et des mesures + date de la signature de la convention du metre.
-Aujourd’hui : les étalons universels sont des étalons définis par le SI.
1.2. Étalons et unités S.I.
*objet inaltérable : étalon de masse
*phénomène physique : étalon mètre
*réactions chimiques (électrode utilisée en électrochimie)
-unité de quantité de matière, la mole symbole : mol
C’est la quantité de matière d’un système contenant autant d’entités élémentaires qu’il y a d’atome dans 0,012 kg de carbone 12 (soit N Avogadro entité)
1.3.Mesure et instrument de mesure
Faire une mesure : c’est comparer une grandeur physique (ou chimique) inconnue avec une grandeur de même nature prise comme référence à l’aide d’un instrument. Elle s’exprime par sa mesure dans une unité de mesure :
-valeur numérique
-analogique (lecture cadran/aiguille)
-numérique (lecture valeur écran)
Il consiste à comparer les valeurs indiquées par l’appareil avec les valeurs de référence correspondante.
Ex : étalonner une balance avec des étalons de masse
Dans certain domaine réglementé, l’étalonnage est obligatoire. Les étalons utilisés doivent être reconnus par des organismes de normalisation, comme BPIM ou ISO.
-MR : matériaux de référence : matériaux ou substances bien définie utilisés pour l’étalonnage des appareils.
MRC : matériaux de référence certifié : ceux-ci sont accompagné d’un certificat précisant l’incertitude à un niveau de confiance indiqué.
Exemple d’appareil à étalonné : balance, spectrophotomètre, pipette automatique…
Le résultat de la vérification de l’appareil se traduit par une décision de conformité :
¤ S’il est conforme, il est remis en service
¤ S’il n’est pas conforme, réaliser un ajustage, une réparation ou une réforme de l’appareil.
2. Techniques d’étalonnage des méthodes d’analyse biochimique
¤ Toute les techniques d’analyse nécessite l’établissement d’une courbe d’étalonnage (c’est la variation d’un signal en fonction de la concentration d’un analyte)
¤Différents domaines d’application > doc. 1 et doc. 2.
Une fois que l’on a les valeurs expérimentales, on fait une modélisation mathématique : c’est la recherche de la fonction mathématique la plus simple qui minimise les écart entre les valeurs expérimentales et le modèle.
2.1.Étalonnage direct : externe
Technique la plus générale et la plus rapide que l’on utilise lorsqu’il n’y a pas d’effet matrice.
¤Les étapes :> préparation de solutions étalon
Ø série de dilutions (progression arithmétique, Vf identique)
Ø ajout éventuel d’un réactif (colorimétrie)
Ø mesure du signal
Ex : dosage colorimétrique des ions phosphates
-préparation de SE : mK2HPO4,3 H2O pure à peser pour 1L à 1 mmol de HPO42- ?
-solution fille : 5 solutions filles de 0 à 1 mmol.L-1
Vf = 4 mL M = 228,2 g.mol-1
m=C*V*M
m=10-3*1*228,2
m=0,2282g
|
Tube
|
Temoin
|
1
|
2
|
3
|
4
|
|
Sol M (mL)
|
0
|
1
|
2
|
3
|
4
|
|
Eau dist (mL)
|
4
|
3
|
2
|
1
|
0
|
|
Cf (mmol/L)
|
0
|
0.25
|
0.5
|
0.75
|
1
|
- dosage UV de la tyrosine
- dosage des proteines par colorimétrie
- dosage de la caféine par la méthode HPLC
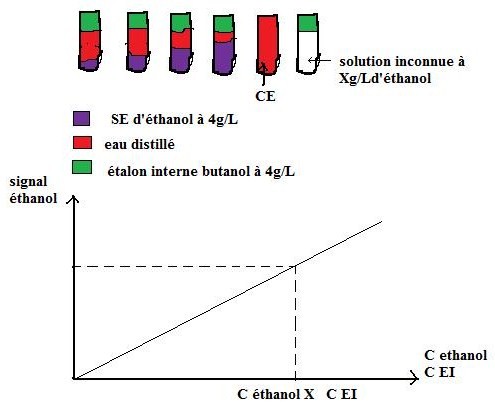
2.2.Étalonnage interne
Il consiste à ajouter une espèce qui est absente de l’échantillon à doser aux solutions étalons et à l’échantillon à doser. C’est la méthode utilisé en chromatographie où les volumes injectés dans la colonne sont très petit et donc non reproductible.
Ex : dosage de l’éthanol par CPG
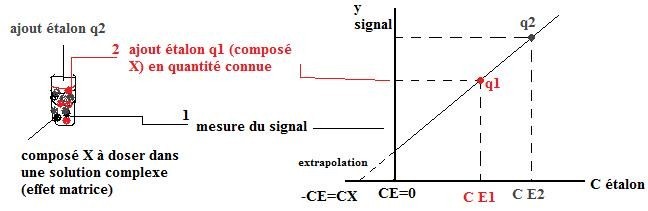
2.3.Étalonnage par méthode des ajouts dosés (standard additions)
*effet matrice : c’est quand l’analyte se comporte différemment vis-à-vis de l’instrument de mesure selon les constituants qui l’entourent.
Problème : on ne peut pas comparer le signal de l’échantillon aux signaux des solutions étalons.
Solution : on va ajouter des étalons, des substances de référence directement dans la solution inconnue.
Après un certain nombre d’ajout, le signal :
y=Kx(Ce+Cx)
y=K*Ce+K*Cx
si y=0 -K*Ce=K*Cx
Ce=Cx
3. Incertitude des mesures
3.1.Définitions
*répétabilité : c’est un même manipulateur qui fait plusieurs fois la même mesure sur le même échantillon avec le même matériel.
*reproductibilité : c’est plusieurs mesures d’un même échantillon par différentes personnes avec des équipements différents mais avec la même méthode.
3.2.Présentation d’un résultat de mesurage.
Selon une norme ISO 17025, qui définit « les exigences générales concernant la compétence des laboratoires d’étalonnage et d’essais. »
Validation des résultats :
*si plusieurs mesures en condition de répétabilité => rendre la moyenne ou la médianes en tenant compte de Sr : écart type de répétabilité.
* à l’aide d’une mesure ponctuelle d’un échantillon contrôle (matériaux de référence accompagné de la valeur de l’incertitude type contrôlé = Uc)
L’expression des résultats doit tenir compte de l’incertitude de la méthode = Uc
4. Sensibilité, linéarité et détection d’une méthode d’analyse
- sensibilité : une méthode donne un signal d’une intensité I relié à la concentration de l’analyte : I=f(C) : sensibilité : S= (∆I)/(∆C) S se calcule à partir de la pente de la droite.
- domaine de linéarité : c’est le domaine de concentration dans laquelle le signal varie de manière linéaire => linéarité constante.
- limite de détection : c’est la plus petite quantité d’analyte qui peut être détecter (pas nécessairement quantifié) avec une bonne certitude et une valeur différente du blanc.
Blanc : c’est une solution de référence qui contient toute les espèces présentes dans la solution sauf l’analyte.
En spectrophotométrie, il permet d’enlever l’absorbance des composés différents de l’analyte au absorbance des étalons et des échantillons.
Ex : -réglage du zéro (spectrophotomètre mono faisceau)
- lecture A contre la référence A-blanc (spectrophotomètre bi faisceau).
biochimie analytique, chapitre suivant