Chapitre 2 : Cinétique enzymatique michaélienne
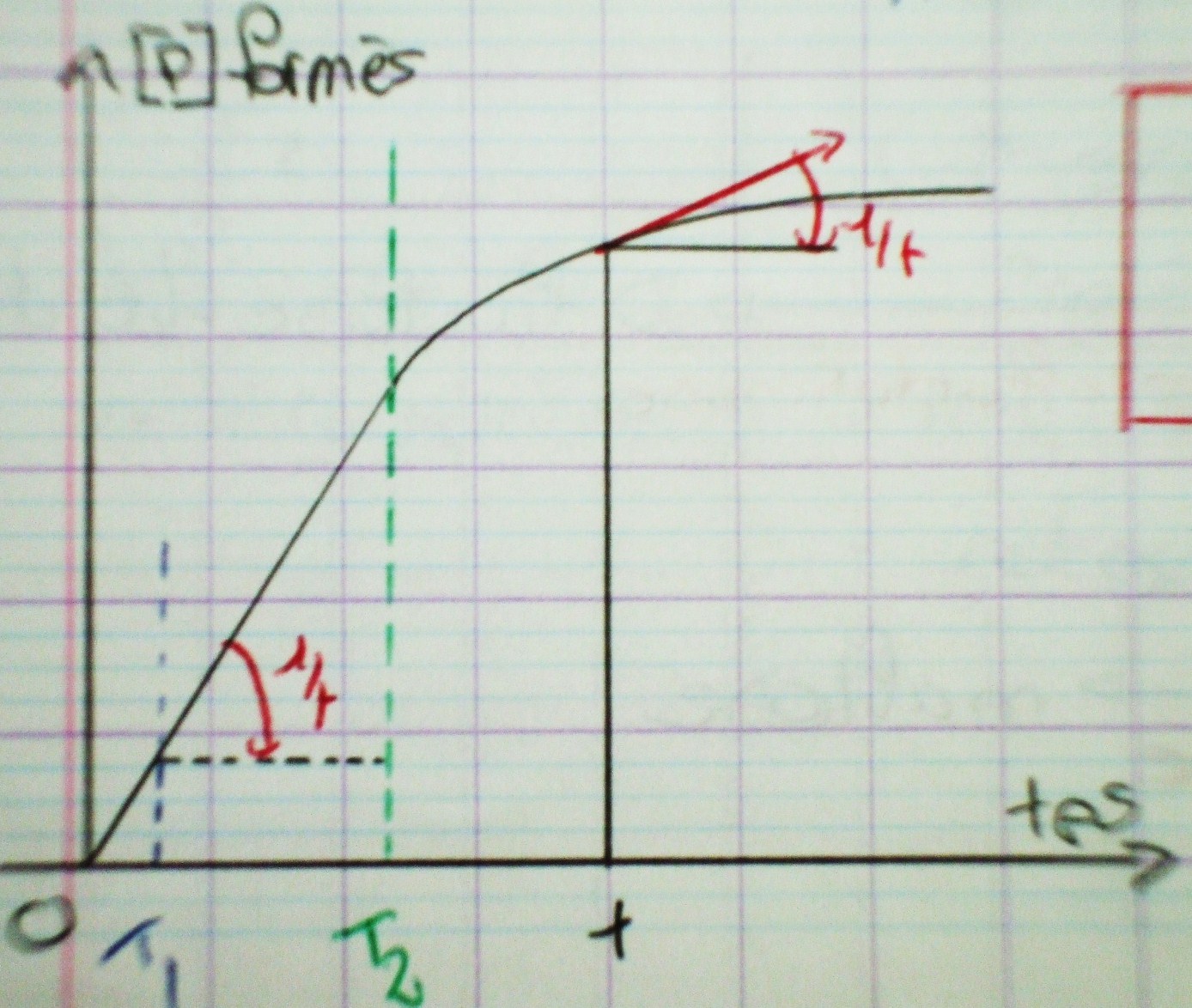
Cinétique d’une réaction Ez (vitesse) : variation en fonction du temps de la quantité (donc de la concentration) d’une molécule (souvent le P) de la réaction.
1. Vitesse d’une réaction enzymatique
αA+βB ====> γC+δD
où A et B : substrats ; C et D : produits ; α, β, γ, δ : coefficients stœchiométriques
1.1. Détermination graphique de la vitesse d’une réaction enzymatique
Cas 1 : suivre la disparition d’un S A ou B en fonction du temps
Cas 2 : suivre l’apparition d’un P C ou D en fonction du temps

1.2. Expression mathématique de la vitesse
Voir chapitre 1
2. Cinétique d’une réaction Ez à un S
2.1. Détermination expérimentale de la Vi d’une réaction
Ex : réaction d’hydrolyse de l’ONPG par la β-galactosidase
2.2. Variation de la Vi
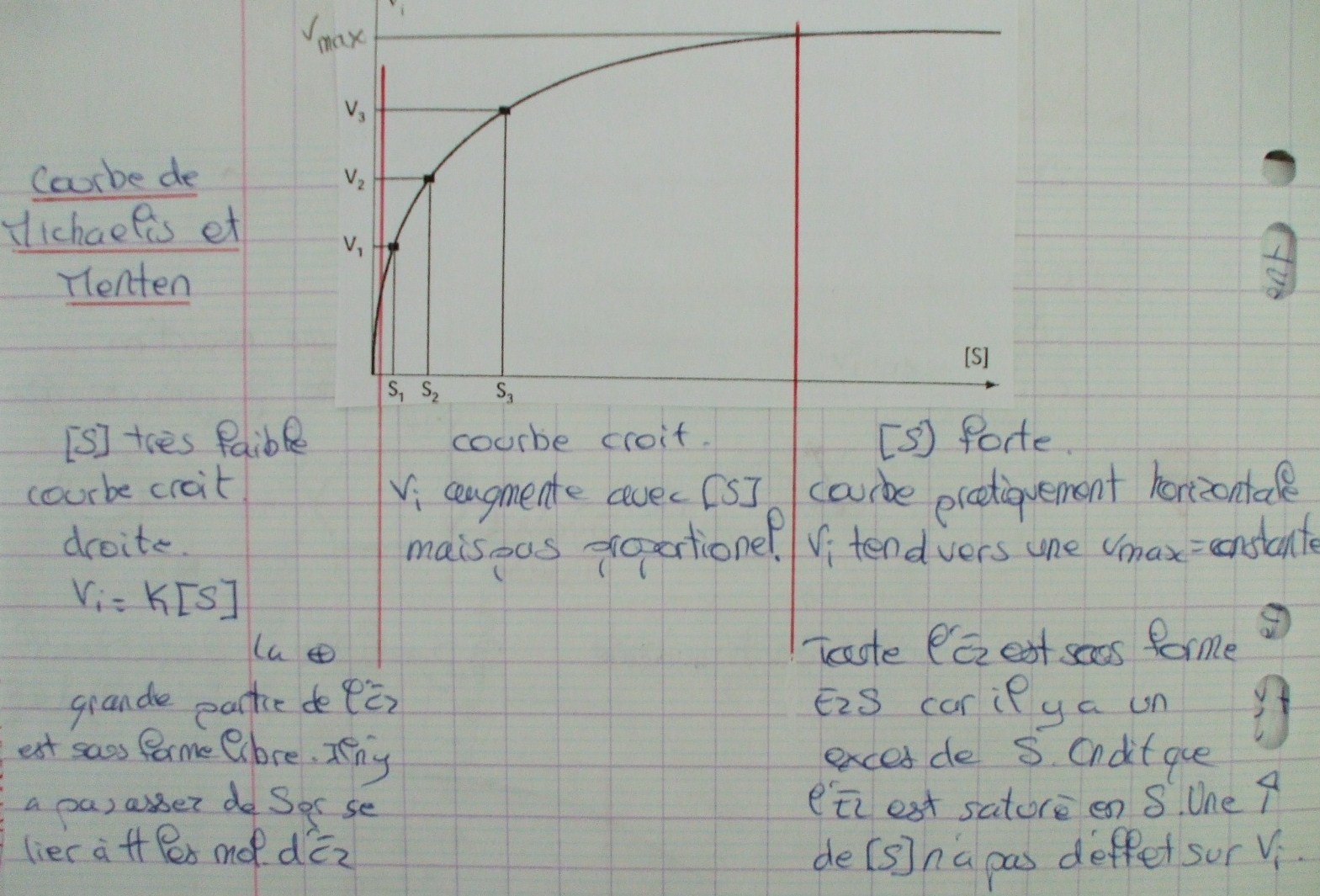
2.2.1. Variation de la Vi en fonction de la concentration de S
Vi augmente avec la concentration en S
La durée de la phase stationnaire augmente avec la concentration en S
Courbe de Michaelis et Menten
La courbe Vi=f([S]) est une hyperbole avec pour asymptote y=Vmax
2.2.2. Variation de Vi en fonction de la concentration en Ez
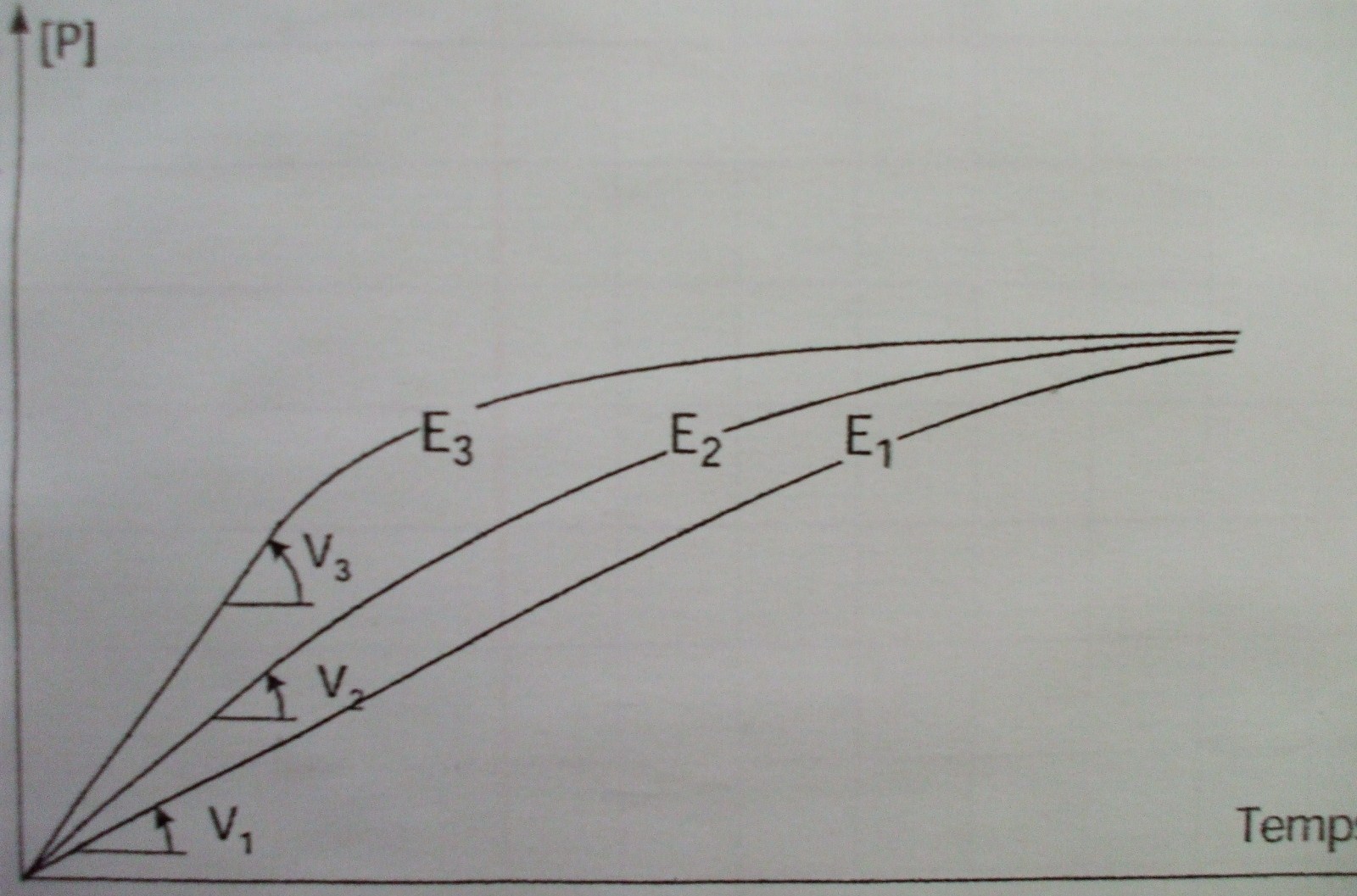
La courbe croit => c’est une droite Vi=k. Jusqu’à E3, la concentration de l’enzyme est faible par apport à la concentration de S => Toutes les molécules d’Ez sont liées au S. La courbe s’infléchit, Vi augmente avec la concentration en Ez, mais plus proportionnellement. Le S n’est plus en excès par apport à l’Ez.
2.3. Théorie de la cinétique à l’état stationnaire
La Vi d’une réaction correspond à une concentration en complexe EzS constante. Elle est mesurée à l’état stationnaire.
Etat stationnaire :
Concentration en complexe EzS constant. La vitesse de formation du complexe est égale à la vitesse de dégradation du S, soit à l’apparition du P.
2.4. Equation de Michaelis et Menten
2.5. Interprétation de Km et Vmax.
Vmax correspond à la vitesse initiale maximale de la réaction. Elle est obtenue lorsque l’Ez est mis en présence d’un large excès de S. Elle est caractéristique d’une Ez dans des conditions expérimentales données (température, pH, force ionique…)
Km est la constante de Michaelis, et correspond à la concentration de S lorsque la Vi atteint Vmax/2. Elle s’exprime en mol/L de milieu réactionnel. Km traduit l’affinité de l’Ez pour son S. Plus le Km est grand, plus l’affinité de l’Ez pour son S est faible.